解锁膜蛋白的“金钥匙”!
2025-03-06
细胞膜是细胞与外界环境的分界线,而膜蛋白(MPs)作为细胞的基本组成成分,介导许多关键过程,如信号转导、成分传输、酶反应、细胞之间的通信等。在生命科学领域,研究膜蛋白对于理解细胞功能、疾病机制及药物开发具有重要意义。膜蛋白的表达与纯化一直是研究中的难点,其复杂的结构、疏水性、低表达量、易形成包涵体以及潜在的毒性使得传统表达方法面临诸多挑战。而无细胞蛋白表达技术( CFPS)的兴起,为膜蛋白研究带来了革命性的变革。
一、膜蛋白表达的挑战
膜蛋白作为一类特殊的蛋白质,其表达与纯化过程尤为复杂。除了常见的问题外(比如:膜蛋白定位、跨膜蛋白疏水性、蛋白毒性、表达水平低等),还有以下一些挑战:
稀有密码子:部分膜蛋白基因含有稀有密码子,这些密码子不能被宿主细胞识别,导致多肽链合成不完全,从而不能形成功能性膜蛋白。
易形成多聚体:膜蛋白在热变性过程中容易形成多聚体,导致抗体无法识别或条带分子量发生变化或扭曲,从而影响实验结果。
提取方法复杂:由于膜蛋白与膜结合紧密,不易从膜上洗涤下来,特别是跨膜蛋白,具有多重跨膜结构域,提取分离困难。目前常用的提取方法包括超速离心、密度梯度离心等,但每种方法都有其局限性。
检测难度大:膜蛋白在样品中的表达量通常不高,在总蛋白中占比较低,用总蛋白检测时,目标蛋白含量可能低于检测下限,无法检测到。此外,膜蛋白的western Blot实验也面临诸多挑战,如条带不清晰、分子量不对或条带扭曲等。
二、CFPS技术在膜蛋白研究中的优势
对于体外结构研究来说(如X射线衍射、核磁共振光谱或交联方法等)CFPS已经成为一个日益重要的研究领域,并且它在其他领域也有很高的潜力,包括工业蛋白质生产等。一般来说,CFPS可以在不使用完整活细胞的情况下进行体外蛋白的合成,只需要合成系统中包含核糖体和氨基酰tRNA合成酶等核心蛋白质表达机制的细胞提取物,同时提供能量恢复系统、氨基酸、NTP、tRNA和DNA等必需的前体即可。与重组蛋白生产相比,它有以下几个主要优势:
CFPS可以表达对细胞有损害的蛋白质或肽,包括膜整合蛋白、疫苗等;
CFPS系统允许通过不同的策略有效地纳入非天然氨基酸(NSAA);
CFPS的蛋白纯化过程可简化为一两个亲和力纯化步骤,表达后的提取物也可以直接应用于下游工作;
CFPS过程中免去了许多耗时和关键的步骤(比如细胞培养);
CFPS允许在开放系统中直接解决降解、错误靶向或不溶性表达等问题,允许独立于细胞活力或生长的情况下优化蛋白质生产。
总而言之,CFPS系统比重组系统具有优势,因为它的开放性允许精确控制环境,包括添加剂和氨基酸,并易于获得表达的蛋白质。此外,这些系统促进了适用于高吞吐量需求的简单优化程序,这使得它对自动化流程更具有吸引力,并且允许高效地纳入非天然氨基酸。
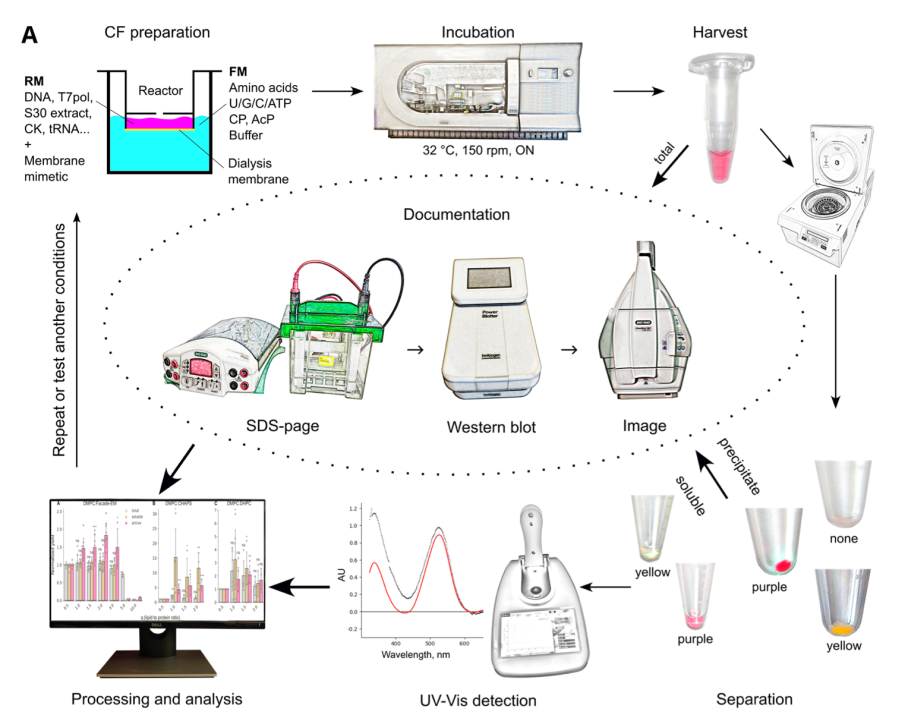
图1:无细胞蛋白表达技术合成膜蛋白的实验方案
三、CFPS技术在膜蛋白研究中的具体应用
CFPS系统是膜蛋白合成的一种新的核心平台。其在人工疏水环境中的表达允许膜蛋白的共翻译溶解和折叠,如纳米膜或胶束。在没有疏水化合物的情况下,合成的膜蛋白可定量沉淀,同时仍然可以保留很大一部分折叠的结构元素。即使是复杂的膜蛋白(比如大型转运体),也可以在几个小时内合成大量此类沉淀物。沉淀物可以在洗涤剂中溶解或重组成膜,以进行后续的结构或功能分析。
我们知道,G蛋白偶联受体(GPCR)在细胞-细胞信号传导过程中发挥着核心作用,是人类基因组中最大的膜蛋白群体,大约35%的商业药物是针对这些蛋白质。对G蛋白偶联受体进行结构研究的先决条件是制备以毫克蛋白质为单位的高度浓缩、稳定且具有生物活性的样本。传统的表达方法会存在很多问题,而CFPS可以规避这些问题。基于其开放性,允许研究人员向系统中添加物质。这促进了蛋白表达和溶解,允许快速筛选出最佳表达条件。
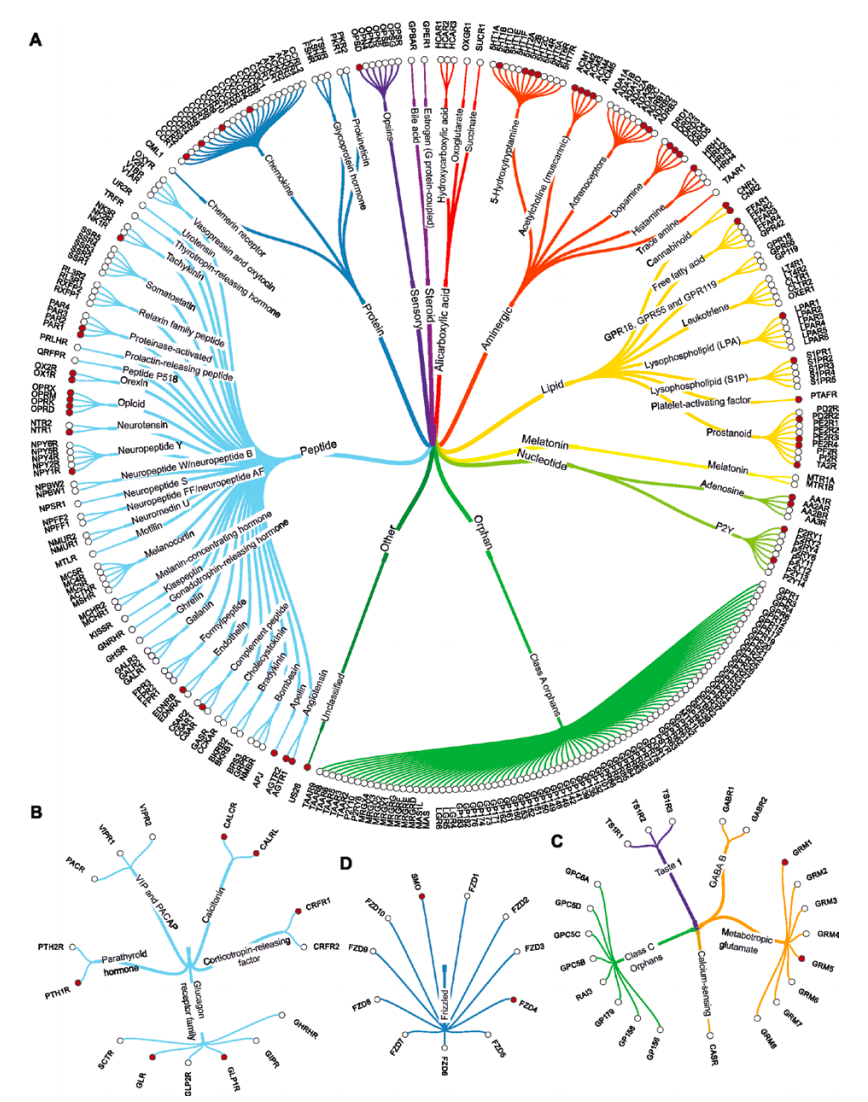
图2:作为药物靶点的GPCRs系统发育树
此外,膜基纳米颗粒(如脂质体、聚合物和脂质纳米颗粒)的表面改性,以及靶向分子(如结合蛋白)的修饰是治疗材料设计的重要一步。然而,这种修饰可能既昂贵又耗时,需要细胞宿主进行蛋白质表达,将会花费漫长的纯化和共轭时间来将蛋白质附着在纳米载体表面,这最终限制了有效蛋白质共轭纳米载体的发展。目前,已有研究使用CFPS系统来快速创建蛋白质共轭膜基纳米载体。使用这种方法,多种类型的功能结合蛋白,包括affibodies、scFvs等,都可以通过无细胞表达,并在一个锅中结合到脂质体上。此外,可以进一步扩展到其他纳米颗粒,包括聚合物和脂质纳米颗粒,适用于多种共轭策略,包括表面附着以及集成到纳米颗粒膜中。利用这些方法,证明了双特异性人工抗原呈递细胞的快速设计,并增强了脂质纳米颗粒货物的体外输送。预计这种工作流程将能够快速生成基于膜的输送系统,并增强我们创建细胞模仿疗法的能力。

图3:膜基纳米颗粒的快速合成
四、总结
CFPS技术正引领膜蛋白研究的革命性突破,它不仅解锁了膜蛋白研究的新篇章,还预示着在结构生物学、药物研发和生物传感器技术等前沿领域的无限可能。随着技术的日益完善,我们有充分的理由期待,这项技术将极大促进膜蛋白功能的深刻理解,加速新药研发进程,并为生命科学的深入探索提供强有力的技术支持,为人类的健康福祉和科技进步贡献力量。
珀罗汀生物依托自主研发的无细胞蛋白表达平台,已成功实现对膜蛋白的高效快速合成,成为膜蛋白表达的救星。
电话:0512-67900128官网:www.cellfreeprotein.cn
参考文献:
Schmidt P, Bender BJ, Kaiser A, et al. Improved in Vitro Folding of the Y2 G Protein-Coupled Receptor into Bicelles. Front Mol Biosci. 2018;4:100. Published 2018 Jan 17. doi:10.3389/fmolb.2017.00100.
Goncharuk MV, Vasileva EV, Ananiev EA, et al. Facade-Based Bicelles as a New Tool for Production of Active Membrane Proteins in a Cell-Free System. Int J Mol Sci. 2023;24(19):14864. Published 2023 Oct 3. doi:10.3390/ijms241914864.
Manzer ZA, Selivanovitch E, Ostwalt AR, Daniel S. Membrane protein synthesis: no cells required. Trends Biochem Sci. 2023;48(7):642-654. doi:10.1016/j.tibs.2023.03.006.
Peruzzi JA, Vu TQ, Gunnels TF, Kamat NP. Rapid Generation of Therapeutic Nanoparticles Using Cell-Free Expression Systems. Small Methods. 2023;7(12):e2201718. doi:10.1002/smtd.202201718.
相关推荐








