无细胞蛋白表达技术:破解难表达蛋白的密钥
2025-08-01
一、前言
天然细胞中的蛋白质合成涉及化学环境、蛋白质-蛋白质相互作用和蛋白质机制之间复杂的相互作用,在制备某些特殊蛋白时会面临诸多挑战,比如膜蛋白的低表达量、毒性蛋白的细胞致死效应以及需要复杂翻译后修饰蛋白的功能缺失等。这些"难表达蛋白"的制备瓶颈严重制约了相关基础研究和临床应用的发展。
无细胞蛋白表达技术(Cell-Free Protein Synthesis, CFPS)通过重构体外转录翻译体系,在人工和无细胞环境中复制这种相互作用可以控制蛋白质合成的精度,为这类"顽固分子"的制备开辟了新路径。
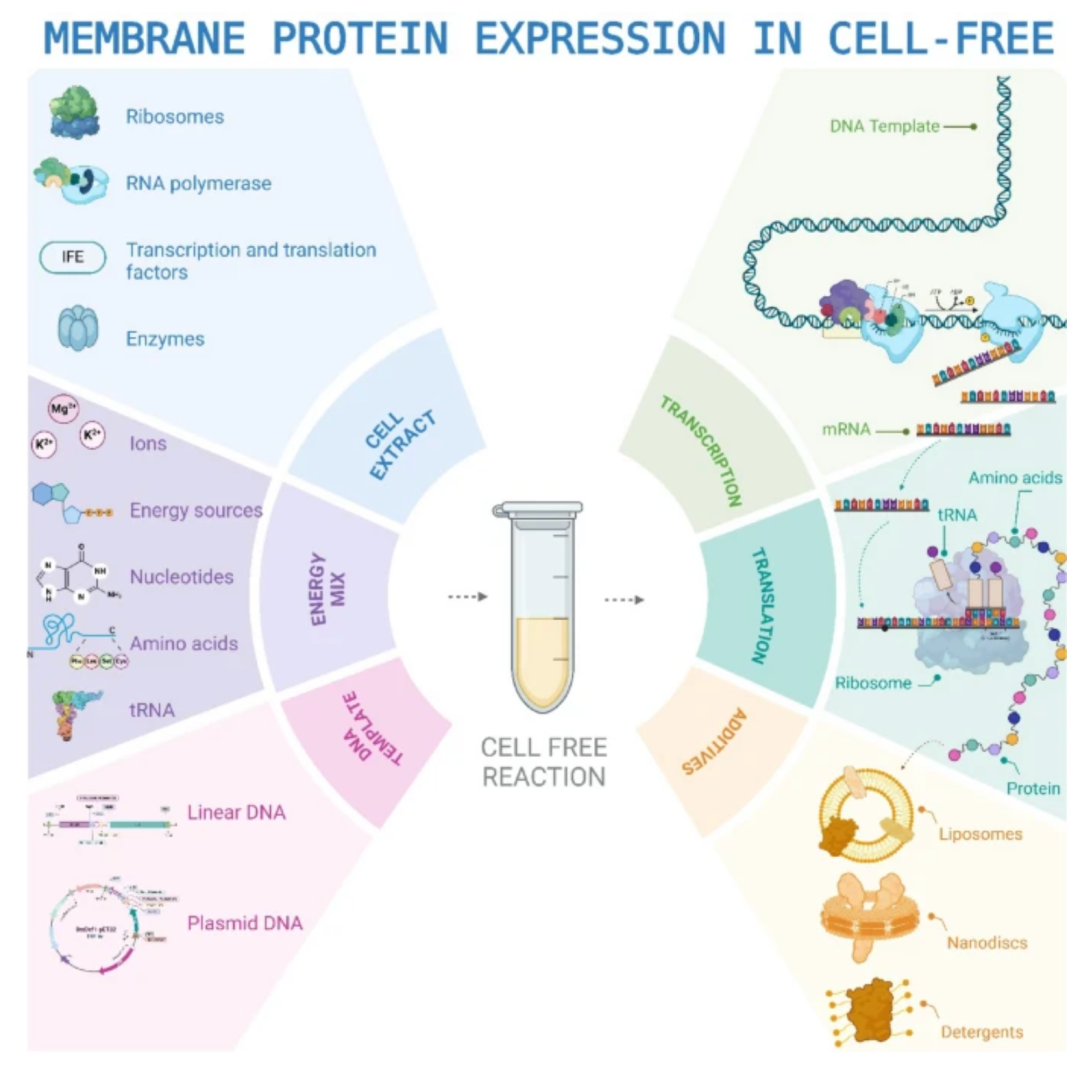
图1:无细胞蛋白表达概述图
一、技术重构:体外生命合成的新范式
无细胞蛋白表达技术通过提取细胞裂解物中的核心生物元件,构建开放式的体外合成系统。该技术突破传统细胞表达的物理边界:
1.细胞膜屏障的消解:通过物理破碎细胞释放核糖体、转录因子等核心元件,消除细胞膜对大分子底物的通透性限制。
2.代谢网络的解耦重构:将能量再生系统(如磷酸肌酸/肌酸激酶)、氨基酸供给、核苷酸循环等模块独立优化,实现代谢通量的精准调控。
二、难表达蛋白的破解密码
1.膜蛋白:跨越脂双层的表达革命
膜蛋白在细胞生物学和生物技术中发挥着至关重要的作用,从细胞信号传导到治疗发现。然而,膜蛋白 (MP) 很难在大肠杆菌等异源菌株中表达,必须使用修饰菌株,有时菌株会产生包涵体,这使得纯化变得困难。鉴于膜蛋白合成的复杂性和对蛋白质-脂质-化学相互作用的有限理解,一种设计人工合成条件的方法至关重要。
无细胞体系通过创新策略实现膜蛋白表达的突破——纳米盘(Nanodisc)技术:一种由磷脂双层构成的微型圆盘结构,提供与天然细胞膜更接近的磷脂双分子层环境,能够高度模拟细胞膜的天然环境;有利于膜蛋白形成正确的天然构象,可以更好的维持膜蛋白构象稳定,有利于下游纯化。
应用实例:珀罗汀生物在自研无细胞体系中加入Nanodisc,成功表达了某融合绿色荧光蛋白(GFP)的膜蛋白,并验证了该膜蛋白成功组装进纳米盘,如图2所示,添加纳米盘时表达情况优于去垢剂组。
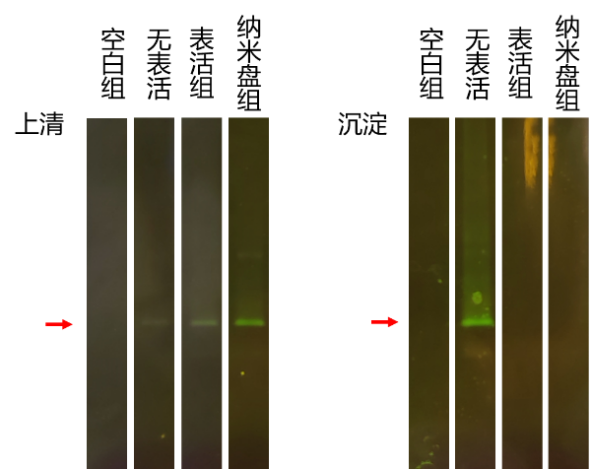
图2:CFPS+Nanodisc表达情况
2. 毒性蛋白:突破细胞耐受的极限
毒性蛋白因具备破坏细胞结构、干扰代谢过程或直接杀伤宿主细胞的能力,在传统表达纯化系统中面临多重技术瓶颈,比如BamHI限制性内切酶在传统大肠杆菌系统中过表达时,其DNA切割活性会抑制宿主生长,表达量极低且难以获得有活性的目的蛋白。
无细胞蛋白表达技术(CFPS)通过体外开放体系彻底规避了传统系统的局限性:
√无细胞毒性:裂解物已失去生命活性,毒性蛋白无法损伤宿主;
√开放式控制:可实时调整反应条件(如添加分子伴侣)优化蛋白折;
√简化纯化:反应液中杂质少,目标蛋白纯度更高,且支持一步亲和纯化;
√高通量能力:支持多孔板或微流控芯片上的并行表达,加速毒性蛋白变体的筛选与优化。
应用实例:珀罗汀生物在自研无细胞体系中成功表达出BamHI限制性内切酶,如图3A所示;并证明了PLD无细胞蛋白表达的BamHI限制性内切酶具有活性,如图B所示(2,3,4,5泳道对应的质粒被切成线性模版,最低浓度为 0.001 ug/uL即可显示酶切活性)。
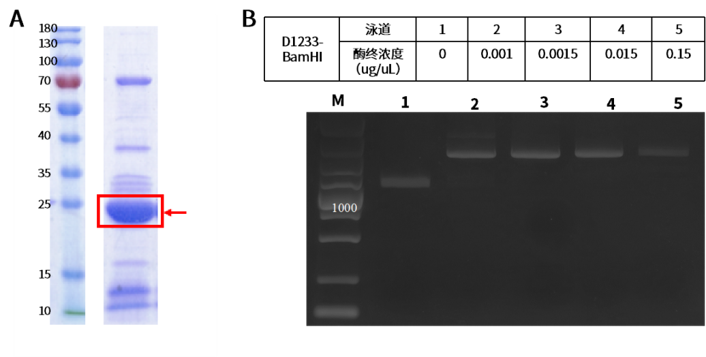
图3:BamHI限制性内切酶在PLD无细胞系统中表达
3. 非天然氨基酸:重塑蛋白研究领域
天然氨基酸的种类数量存在一定局限,且其化学结构相对保守。基于天然氨基酸构建的天然蛋白质,在应对蛋白质工程以及蛋白药物开发等领域的复杂研究需求时,难以提供全面且有效的支持。而非天然氨基酸( nnAAs)拥有丰富多样的侧链基团结构。当把其引入蛋白质中时,能够为蛋白质带来全新的化学特性、独特的空间结构以及特殊的功能表现,为生物研究、生物治疗学以及合成生物学等学科领域提供了全新的探索方向和研究方法。
与细胞蛋白表达相比,无细胞蛋白表达系统在非天然氨基酸插入领域具有天然优势:
√ 无细胞系统没有细胞膜阻碍,规避了nnAAs选择性问题;
√无细胞系统不受nnAAs可能产生的细胞毒性作用影响;
√有利于精细调控反应进程。
应用实例:珀罗汀生物对绿色荧光蛋白(GFP)进行非天然氨基酸定点插入,在CFPS体系中成功表达了含非天然氨基酸(pAcF/pAzF)的GFP,其中pAcF插入效率超过70%,如图4所示。
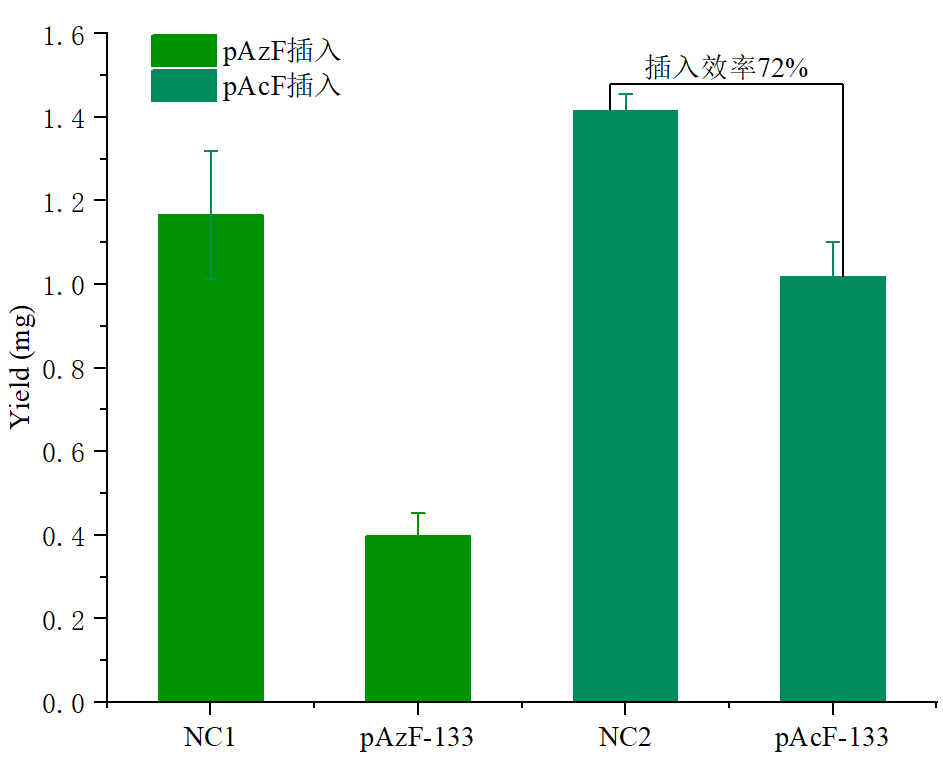
图4:PLD无细胞系统中非天然氨基酸插入
三、未来展望:智能化的蛋白合成工厂
随着AI技术的融入,无细胞体系正向智能化方向演进,未来,无细胞蛋白表达技术与人工智能的深度融合将引领生物制造领域迈向全新高度,催生“智能、灵活、绿色”的蛋白生产新范式。一方面,AI将贯穿蛋白设计、反应优化到质量控制的全链条,通过海量数据训练与实时反馈机制,实现生产流程的自动化与精准化,显著缩短研发周期并降低成本;另一方面,无细胞系统的开放性与模块化特性,将与AI驱动的分布式生产网络结合,构建去中心化的“蛋白智造工厂”,使个性化医疗、现场应急合成等场景成为现实。
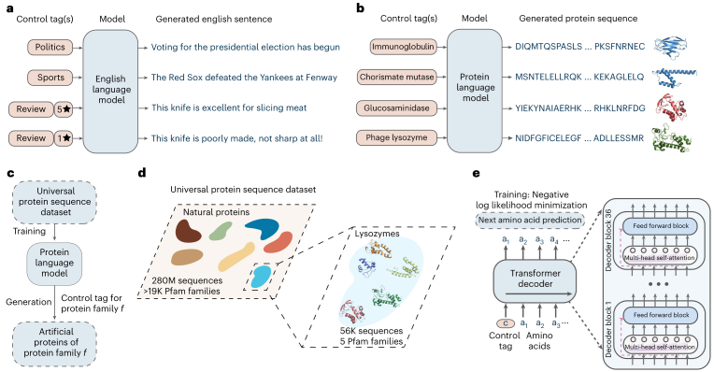
图5:使用条件语言建模的人工蛋白质生成
1. Garenne, D., et al., Cell-free gene expression. Nature Reviews Methods Primers, 2021. 1(1): p. 49.
2. Silverman, A.D., A.S. Karim and M.C. Jewett, Cell-free gene expression: an expanded repertoire of applications. Nature Reviews Genetics, 2020. 21(3): p. 151-170.
3. González-Ponce, Karen Stephania et al. Cell-Free Systems and Their Importance in the Study of Membrane Proteins.The Journal of membrane biology vol. 258,1 (2025): 15-28.
4. Manzer ZA, Selivanovitch E, Ostwalt AR, Daniel S. Membrane protein synthesis: no cells required. Trends Biochem Sci. 2023 Jul;48(7):642-654.
5. Gulezian E, Crivello C, Bednenko J, Zafra C, Zhang Y, Colussi P, Hussain S. Membrane protein production and formulation for drug discovery. Trends Pharmacol Sci. 2021 Aug;42(8):657-674.
6. Hedin, L. E., Illergård, K. & Elofsson, A. An introduction to membrane proteins. J. Proteome Res.10, 3324–3331 (2011).
7. Madani, Ali et al. “Large language models generate functional protein sequences across diverse families.” Nature biotechnology vol. 41,8 (2023).
相关推荐
2025-12-05
2025-12-05
2025-12-05








