文献分享 | 细胞外囊泡相关DNA在癌症生物学中的重要性及其潜在临床应用
2025-07-11
本期简介
近日,德国埃森大学医院的研究团队在期刊《 Journal of Extracellular Vesicles》上发表了一篇报道,名为“Unravelling the Significance of Extracellular Vesicle-Associated DNA in Cancer Biology and Its Potential Clinical Applications”,该文章探讨了细胞外囊泡相关DNA在癌症生物学中的作用及其在临床应用中的潜力,重点关注其作为生物标志物和治疗工具的可能性。

摘要ABSTRACT
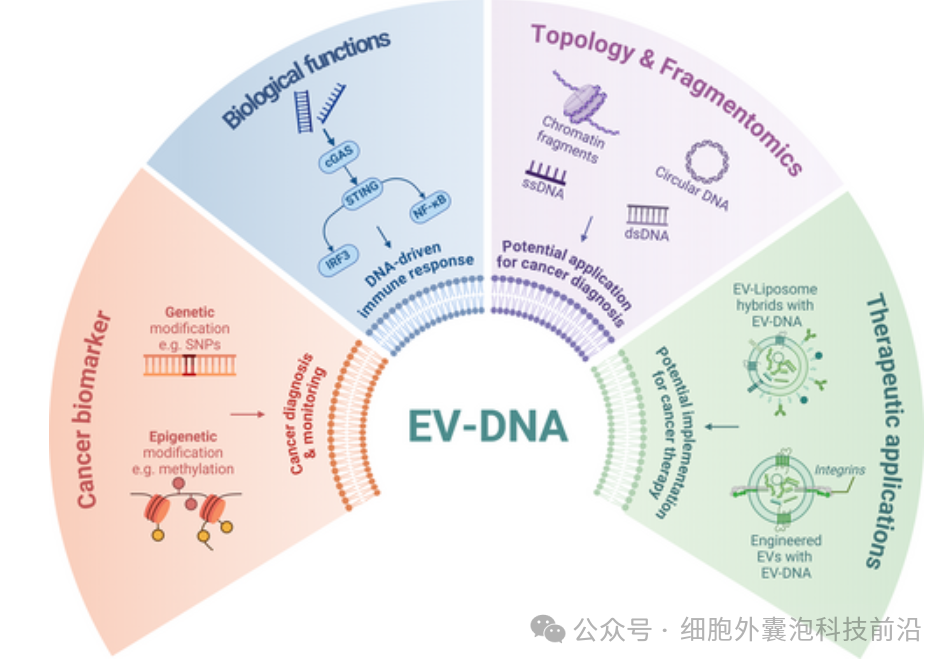
细胞外囊泡(EVs)在细胞间通讯中发挥着关键作用,并因其潜在的临床应用而受到广泛关注。然而,关于与EV相关的DNA(EV-DNA)的生物学仍有许多未解之谜。EV-DNA由正常细胞和恶性细胞主动释放,包含不同结构的多种片段。由于EV-DNA覆盖了其来源细胞的整个基因组,它仍然是癌症诊断和监测的有吸引力的生物标志物。
此外,EV-DNA的传递可以通过干扰细胞质DNA传感通路改变受体细胞的功能。本综述探讨了EV-DNA的生物学及其重要性,包括其拓扑结构、片段特征、与EV的结合方式、包装机制以及潜在功能。综述还强调了囊泡DNA在识别癌症中遗传和表观遗传变化中的特异性。此外,还深入讨论了EV-DNA对细胞行为的影响及其作为癌症治疗靶点的潜力。本文还讨论了EV-DNA生物学的新见解,并提供了针对未来EV-DNA研究挑战和问题的观点和替代方案。
背 景
由于其在遗传信息储存中的独特作用,自身DNA通常被认为局限于细胞核以及线粒体和叶绿体等内共生细胞器中。细胞可释放出多种携带核苷酸(如RNA或DNA)的EVs。越来越多的证据表明,细胞可主动将DNA释放到EVs和微泡中,这些统称为EV相关DNA(EV-DNA)。近期,研究还发现了一类新型EV组分,即具有染色质结构的DNA,称为EV-染色质(EV-chromatin)。
EV-DNA也可由代谢活跃的细胞释放,这一点超越了单纯由凋亡过程中释放的无细胞DNA(cfDNA)的认知。循环cfDNA已被广泛研究用于癌症的液体活检诊断和监测。近年来,EV-DNA作为癌症液体活检的一种有前景的生物标志物也受到关注,为癌症诊断领域带来了新的希望。有趣的是,与cfDNA相比,囊泡DNA在检测癌症的遗传和表观遗传改变方面显示出更高的特异性,这进一步印证了该研究方向的进展。
EV-DNA 是与 EVs 相关联的 cfDNA
无细胞DNA(cfDNA)是指存在于细胞外、包括组织间隙、循环系统或体液中的DNA。这些DNA可以以裸DNA的形式存在,或与蛋白复合物结合,亦或被包裹在EVs内部或附着于其表面。
cfDNA的释放大致可分为两类:一类是源于细胞凋亡、坏死或NETosis等细胞死亡过程;另一类是通过EVs的主动释放。这表明EV-DNA是cfDNA中的一个独立分支,且可能具有生物学活性。cfDNA与EVs的关联在研究中产生了一些相互矛盾的结果,可能源于对EV所携带cfDNA比例尚缺乏深入分析。这种差异性可能与血液样本实验处理方式有关,特别是考虑到循环cfDNA的半衰期较短。EVs可在其脂质双层膜的内外携带DNA。cfDNA可能在被释放至细胞外空间或循环系统后被包裹至EVs内部,或附着于其表面。因此,在本综述中,“cfDNA”一词特指体液或细胞培养基中不与EV相关联的DNA片段,这一类DNA与EV-DNA构成两种不同的细胞外DNA群体。
EV-DNA的拓扑结构、片段组学及定位
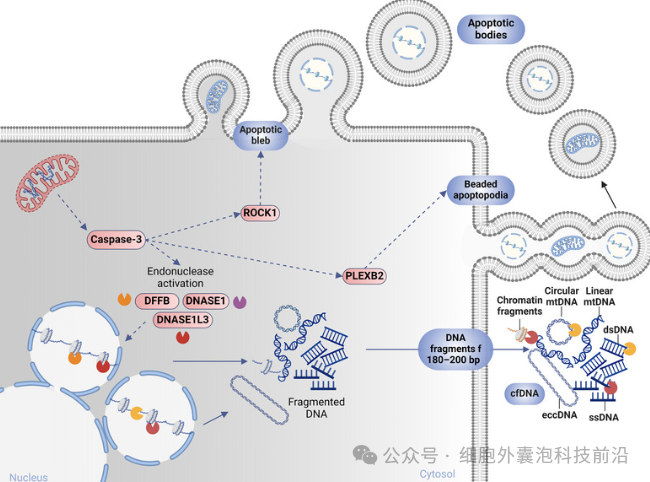
游离cfDNA主要由基因组来源的短片段(40–200 bp)构成,但也可能包含线粒体DNA(mtDNA)和细菌DNA,其拓扑结构包括单链、双链及环状形式(如染色体外环状DNA),片段化模式受核小体排列、染色质结构及核酸酶活性影响,单链cfDNA对超短片段检测更敏感,适用于术后排异监测。
游离 cfDNA 在凋亡囊泡中的被动释放
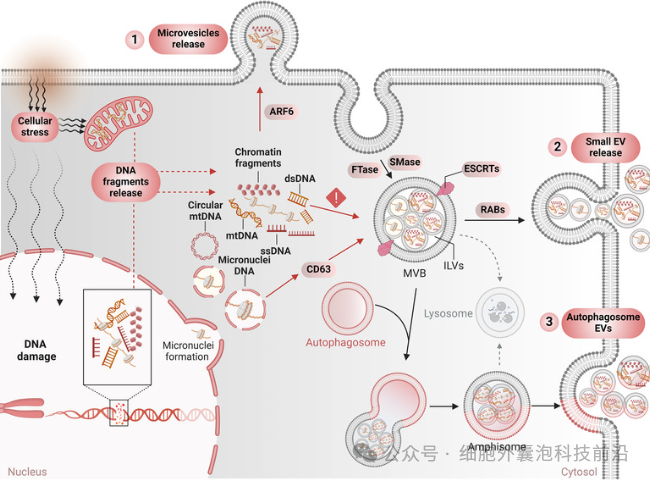
cfDNA 在细胞外囊泡中的主动释放
EV相关DNA(EV-DNA)可携带ssDNA、dsDNA及mtDNA,片段长度跨度大(100 bp–10 kb),且包含染色质化DNA(EV-chromatin),其定位因细胞类型而异:表面DNA可能影响EV物理特性,而内腔DNA更稳定,抵抗DNase降解,是受体细胞摄取的主要形式。EV-DNA的双层膜结构保护其免受酶解,兼具核苷酸与蛋白(如组蛋白)负载能力,为肿瘤液体活检提供高特异性标志物,在遗传/表观遗传异常检测中优于cfDNA。
EV-DNA 与 cfDNA 在液体活检中的应用是否可互为补充?
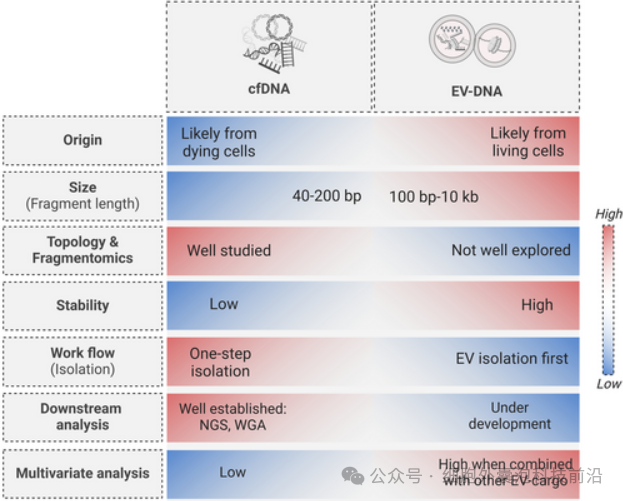
cfDNA广泛存在于体液中,但容易受降解、清除等因素影响,半衰期短,主要来源于凋亡细胞,缺乏组织特异性。而EV-DNA封装于细胞外囊泡中,更稳定,来源于活细胞,包含更完整的核DNA和mtDNA,能提供更具临床价值的信息。
EV-DNA 和 cfDNA 特性的比较分析
多项研究表明EV-DNA在检测癌症突变(如KRAS、TP53)方面优于cfDNA,尤其在胰腺癌患者中表现突出,反映出其在肿瘤早筛、分型和疗效预测中的潜力。EV-DNA已被用于检测胶质瘤、肺癌、膀胱癌等中的多种分子特征,包括突变、CNV、甲基化等。相比cfDNA,EV-DNA更贴近肿瘤组织本身,在反映肿瘤异质性与动态变化方面更有优势。EV中的mtDNA作为新型肿瘤标志物,已在肾癌、卵巢癌和胶质母细胞瘤中展现诊断与分型潜力,甚至能反映肿瘤来源和分泌机制差异。EV-DNA在肺泡灌洗液、尿液等样本中对特定癌种的检测优于cfDNA,如尿液EV-DNA可用于膀胱癌的无创筛查与监测,展现出样本类型选择对检测效果的显著影响。
EV-DNA分析仍面临回收率低、操作繁琐、标准化不足等问题,限制其临床应用。未来需开发高效、灵敏、标准化的检测平台,结合cfDNA,实现更全面、高效的癌症液体活检策略。
细胞外囊泡中DNA的生成与包装机制:目前我们已知的有哪些?
目前关于EV-DNA的生物发生及其包装机制的研究仍处于初步阶段,但随着EV-RNA研究的进展(如MISEV2023指南所述),我们对EV中核酸的富集特征与选择性加载有了更深入理解。EV中DNA和RNA的浓度取决于细胞类型及其生理/病理状态,说明在特定条件下核酸会选择性进入EV。已有研究显示,EVs中可包含mRNA、lncRNA、miRNA,以及ssDNA、dsDNA和染色质片段,但RNA的分选机制比DNA更为清晰,例如miRNA中存在EXOmotif序列驱动加载。相比之下,EV-DNA的加载机制尚不明确,目前推测其可能与胞内DNA浓度、稳定性或特定结构有关。有研究发现EV亚群中DNA的含量不同,高密度EV中DNA更丰富,提示DNA包装可能具有选择性。Yokoi等人提出微核可作为EV-DNA来源,并发现CD63介导其与多泡体相互作用,但该机制无法解释正常细胞或线粒体DNA的来源。其他研究则指出核膜不稳定或细胞迁移相关机制(如DIAPH3缺失、ARF6活性循环)可促进肿瘤细胞释放含DNA的微囊泡,且cGAS作为细胞质DNA感应器可能参与选择性DNA加载过程。尽管如此,EV-DNA是否普遍存在于所有EV类型中、其加载过程是否存在特异识别结构仍待明确。特别是在肿瘤环境下,癌细胞可能通过特定分选机制将特定突变或表观遗传修饰的DNA优先封装至EV中,这些机制不仅与EV生物合成密切相关,也为未来肿瘤治疗提供潜在靶点。
EV-DNA:摄取和功能
关于内源性EV-DNA片段功能的研究主要集中在DNA传感器(如cGAS和AIM2)激活以及DNA模式识别(如TLR)的作用。近期有研究提出,细胞将有害DNA包裹并释放到EVs中,以防止DNA在细胞质中的积累,从而维持细胞的正常稳态。研究发现,暂时抑制ALIX和RAB27a的EV释放可导致DNA片段在细胞质中的积累,并激活STING通路,进而通过ROS依赖的DNA损伤反应促使细胞发生凋亡或衰老样周期停滞。此外,EV-DNA与克罗恩病等炎症性肠病相关,其中EV-DNA的浓度与疾病活动性呈正相关。在急性髓性白血病(AML)中,EVs能够将染色质样结构转移到骨髓间充质干细胞,调节其增殖并可能通过非突变性失活p53来促进干细胞的增殖。
EV DNA 摄取及其与受体细胞区室的相互作用
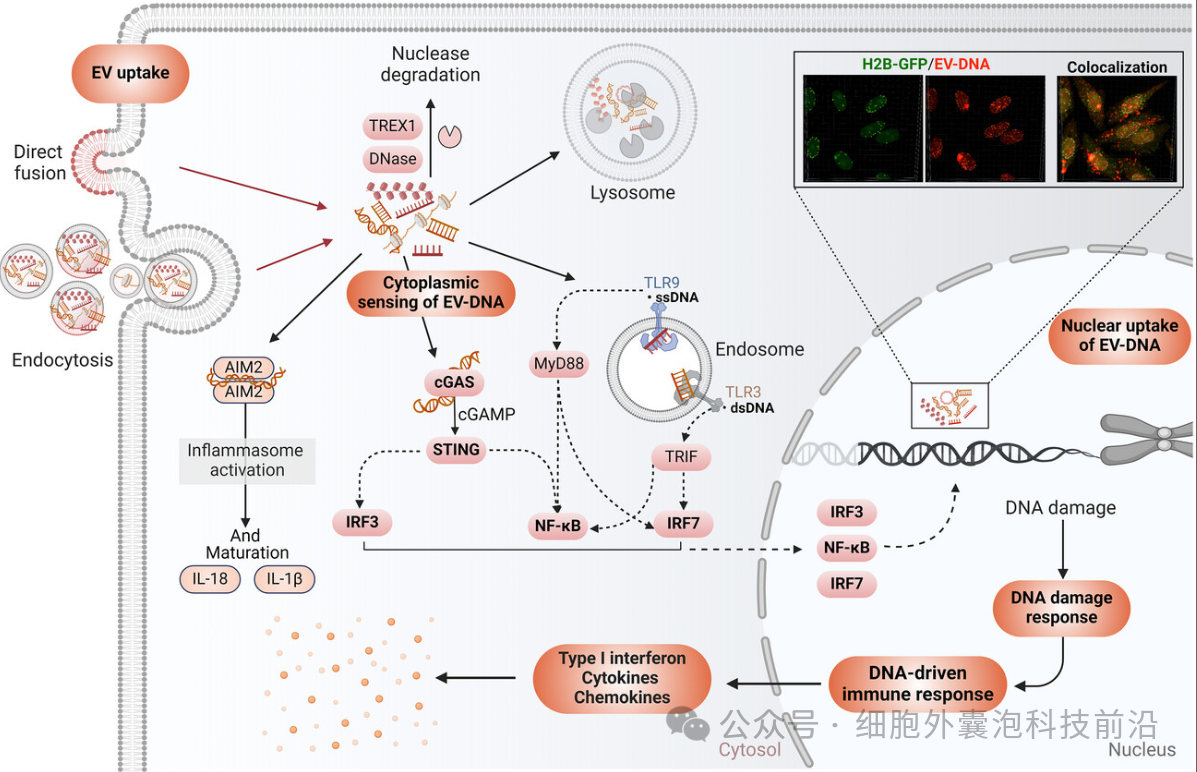
线粒体DNA(mtDNA)及其相关突变在癌症研究中备受关注,因为它们与疾病的发展和对治疗的耐药性密切相关。研究表明,小EVs能够将完整的线粒体基因组转移到代谢受损的乳腺癌干细胞中,帮助恢复其代谢活性,从而促进肿瘤进展。此外,富含mtDNA的EVs在多种病理状态下作为DAMP分子发挥作用,包括衰弱、衰老和肝纤维化等。
用于治疗应用的 EV-DNA
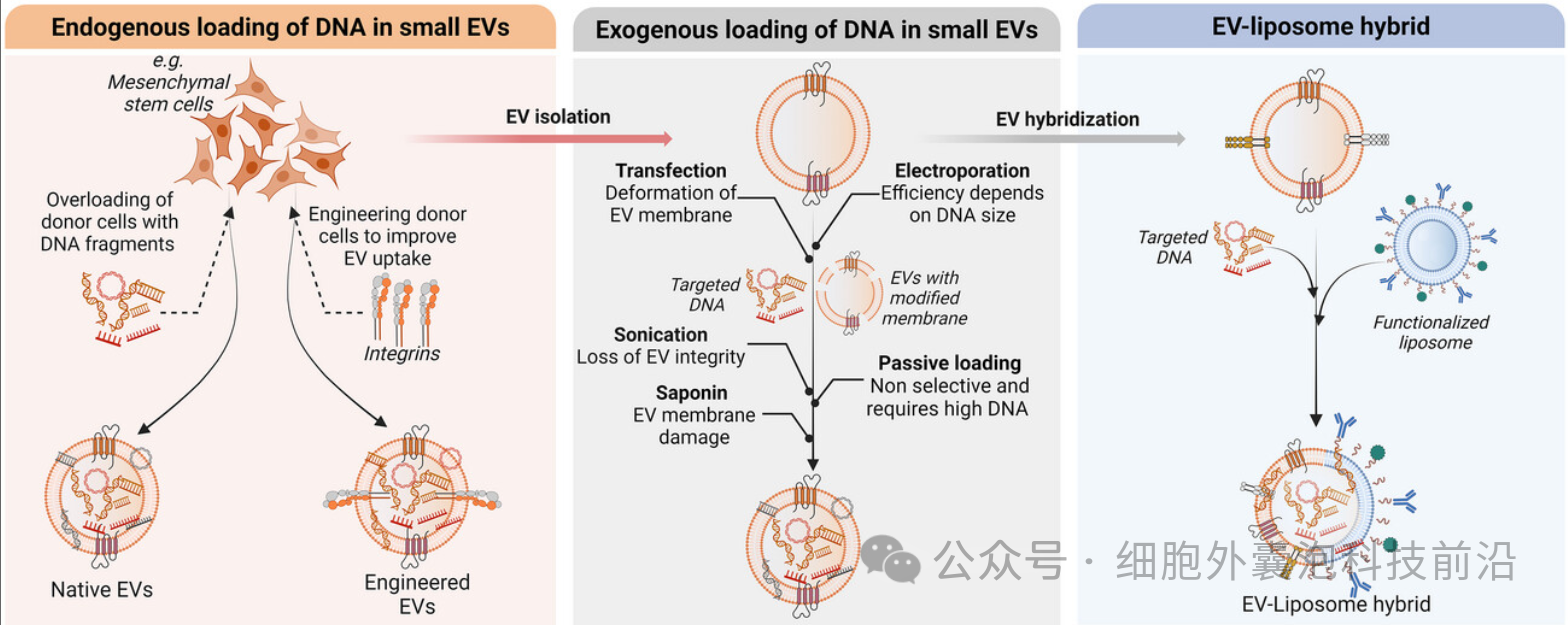
细胞外囊泡(EV)作为生物纳米颗粒在靶向药物递送中展现出巨大的潜力,尤其在基因治疗和RNA干扰应用中。与传统的合成载体相比,EV具有更低的免疫原性和毒性,其表面标记物能引导EV特定靶向器官。EV的载体特性使其成为理想的药物递送工具,并且可以通过转染或电穿孔等方法加载核酸。尽管如此,如何优化不同EV亚群的加载效率仍需进一步研究。
将 DNA 加载到小型 EV 中的方式
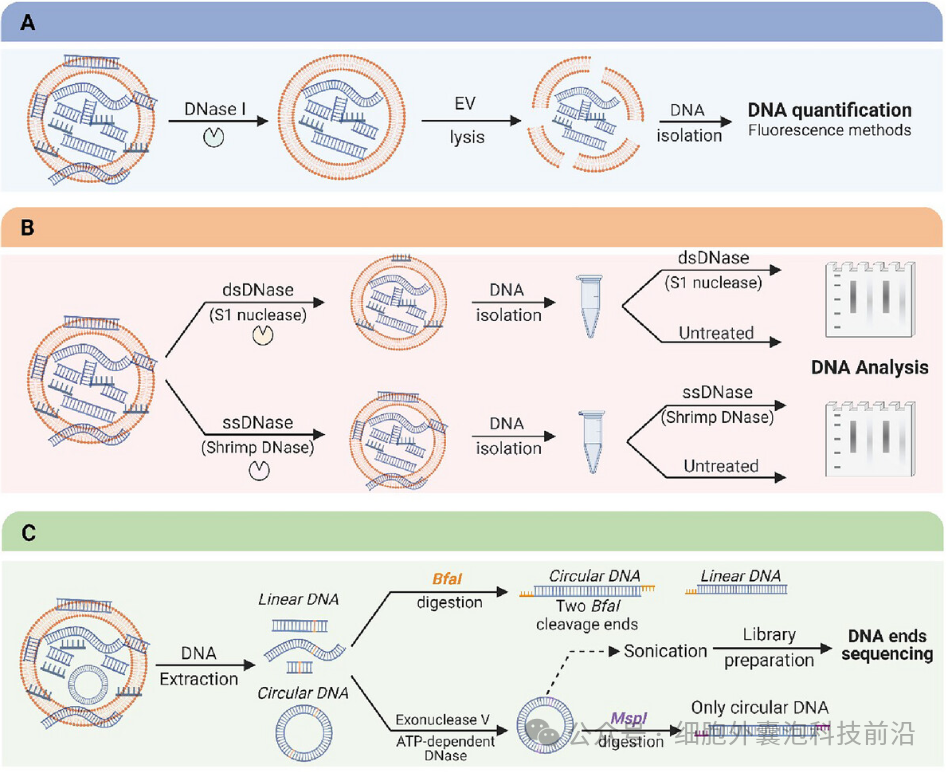
研究 EV-DNA 的实验策略
结论和观点
尽管细胞外囊泡(EV)在原核生物和低等真核生物中已被证实参与遗传物质交换,但在高等生物中,EV-DNA的结构、包装机制及其功能仍未完全解明。当前研究多集中在癌症相关突变的检测,而EV-DNA的片段组学和拓扑特征尚未深入探索。EV的摄取途径和DNA携带EV群体的识别仍面临技术挑战,未来需通过超分辨率显微镜等新技术研究EV-DNA的排序和加载机制。尽管如此,EV-DNA在治疗中的潜力正在持续开发,解决相关难题将有助于其临床应用。
参考文献:Ghanam J, Lichá K, Chetty VK, Pour OA, Reinhardt D, Tamášová B, Hoyer P, Lötvall J, Thakur BK. Unravelling the Significance of Extracellular Vesicle-Associated DNA in Cancer Biology and Its Potential Clinical Applications. J Extracell Vesicles. 2025 Mar;14(3):e70047. doi: 10.1002/jev2.70047. PMID: 40091452; PMCID: PMC11911540.

相关推荐
2025-12-05
2025-12-05
2025-12-05








