外泌体综述:CAR-T 细胞疗法的新前沿
2025-06-06
本期简介
近日,美国西北大学Adam Y. Lin、Athena Demeros研究团队在《Neoplasia》杂志上发表了名为“Exosomes in review: A new frontier in CAR-T cell therapies”的综述,指出了CAR 外泌体具有抗肿瘤活性且无细胞因子释放综合征,还有新型双抗靶向肿瘤来源外泌体阻断免疫抑制。
摘要
外泌体是一种细胞外载体,通过运输关键蛋白质和遗传物质来促进细胞内通讯。每个外泌体本质上都反映了其来源细胞的特征,甚至能够模拟其母细胞的效应功能。近年来,随着CAR - T疗法取得成功,人们对表征源自CAR - T细胞的外泌体的兴趣日益浓厚。CAR外泌体含有与母细胞相同的细胞毒性颗粒,并且在体外实验和动物模型中已显示出显著的抗肿瘤活性。此外,在动物模型中输注CAR外泌体不会引发细胞因子释放综合征。相反,也有新型双特异性抗体靶向肿瘤来源的外泌体,以期阻断由恶性细胞产生的外泌体所介导的免疫抑制途径。两个最具前景的例子包括:(a)BsE CD73 x EpCAM,它能够结合并抑制外泌体CD73,从而抑制免疫抑制性腺苷的产生;(b)BsE CD3 x PD - L1,它靶向肿瘤微环境中的外泌体PD - L1,将细胞毒性T细胞引导至肿瘤细胞。随着我们对外泌体生物学的理解不断深入,细胞疗法取得进展的机会也将随之增加。
01工程化T细胞改变了血液恶性肿瘤治疗的格局
近年来,工程化嵌合抗原受体T细胞(CAR - T)疗法在恶性血液病治疗方面取得了重大进展。自2012年艾米丽·怀特黑德接受治疗并长期缓解,该疗法已获批用于多种血液癌症,像大B细胞淋巴瘤中的liso - cel和axi - cel等产品,在三线治疗中效果突出,部分患者或可治愈,真实世界也证实了其疗效的持久性。2024年ASCO上公布的liso - cel二线III期试验3年随访结果显示,相比标准治疗,CAR - T在总缓解率、完全缓解率、无事件生存期和总生存期等方面均有显著提升。自2017年首个CAR - T疗法获批,其应用从复发难治性疾病拓展到一线治疗。目前,如何改善T细胞群体、去除影响细胞健康的因素是研究重点。例如,苯达莫司汀会降低T细胞数量及CAR - T疗效,T细胞数量、健康状态和表型都与治疗效果相关。而T细胞外泌体作为新兴研究方向,正助力提升细胞疗法的效果 。
02什么是外泌体
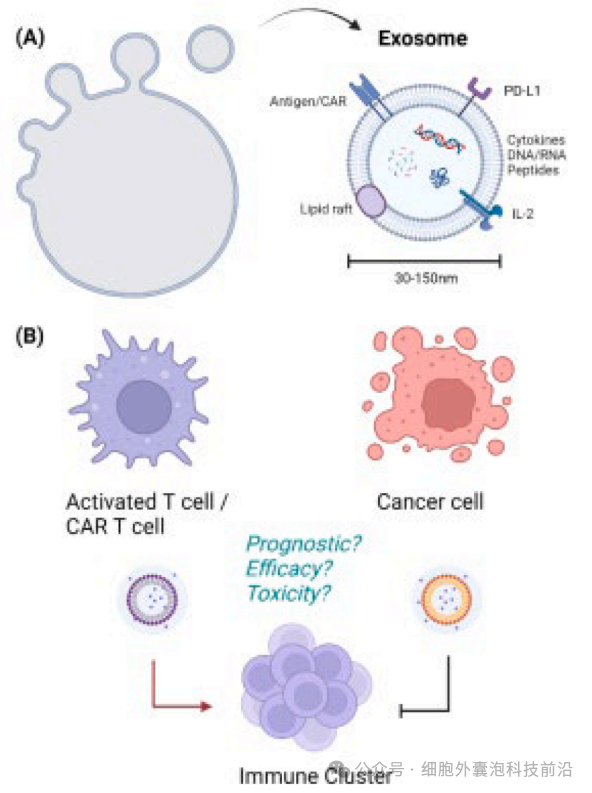
外泌体属于细胞外囊泡(EVs)的一种。EVs是一组异质性的膜结合结构,通过交换信号蛋白、遗传物质及其他物质,在细胞通讯中发挥不可或缺的作用。因其富含胆固醇、鞘磷脂和神经酰胺的脂质膜,EVs在体液中高度稳定,一般分为外切体和外泌体两大类。外切体直径在50纳米至1微米间,直接从质膜出芽形成;外泌体则较小,直径约30 - 150纳米,源于细胞内体,之后释放到细胞外空间以辅助细胞内通讯。外泌体专门负责细胞间蛋白质、核酸和代谢物的运输,在某些情况下,能为主要组织相容性复合体提供肽源,参与抗原呈递和启动适应性免疫系统。外泌体是多泡体中的腔内囊泡,只有在多泡体膜与质膜在胞吐过程中融合,将腔内囊泡释放到细胞外空间时,才被称为“外泌体”。多泡体由细胞内吞细胞外成分(如蛋白质、代谢物等小分子)形成,这些成分被含有原始细胞表面蛋白的细胞膜部分包裹。经反式高尔基体和内质网复合体加工成早期内体,早期内体再次内陷产生多个腔内囊泡(即未来的外泌体),进而发展为多泡体。最终,多泡体的外膜包裹多个较小的腔内囊泡,在胞吐时与细胞膜融合释放到细胞外,其成分因来源细胞不同而高度异质。
03T细胞生物学和T细胞外泌体
T细胞主要分为CD4+辅助T细胞和CD8+细胞毒性T细胞(含CTLs)。其在胸腺中发育,前体细胞经多轮选择和谱系分化,先在RAG控制下进行TCR重组,再经正、负选择形成CD4+或CD8+T细胞群体。CD4+T细胞与抗原-MHC II复合物作用后激活,调节免疫系统。近年来,人们对其及衍生外泌体与其他免疫细胞的作用兴趣渐浓,如IL-2激活的CD4+T细胞外泌体可激活潜伏HIV,还能启动树突状细胞抗病毒,改造的Jurkat T细胞释放的含miRNA外泌体有抗肿瘤活性。CD8+CTL与肿瘤抗原-MHC I复合物作用后激活,是抗肿瘤关键,激活的CTL释放的细胞毒性外泌体可破坏肿瘤细胞,过表达PD-1的T细胞系产生的外泌体可避免免疫细胞受抑制。
04CAR-T细胞疗法和CAR-T细胞外泌体
CAR - T细胞疗法中的CAR - T细胞含有工程受体,其由识别肿瘤抗原(如淋巴瘤的CD19和骨髓瘤的BCMA)的胞外结合域和负责T细胞激活的胞内组件构成。与其他T细胞一样,CAR - T细胞也分泌外泌体等细胞外囊泡。CAR - T细胞释放的外泌体(CAR外泌体),其脂质膜表面携带所制造的嵌合抗原受体及大量细胞毒性分子,且表面CAR蛋白浓度与母细胞相同。CAR外泌体直径呈纳米级,能有效穿透实体肿瘤微环境,这是较大的CAR - T细胞难以做到的。例如,靶向间皮素的CAR - T细胞外泌体可抑制小鼠乳腺癌生长。同时,无细胞的CAR外泌体不受肿瘤微环境中T细胞免疫抑制修饰的影响。因其尺寸小,在穿透血脑屏障方面有优势,或能增强CAR - T疗法对中枢神经系统肿瘤的疗效。此外,CAR外泌体可作为载体加载抗癌药物,如在非小细胞肺癌小鼠模型中,吸入载有紫杉醇的CAR外泌体可减小肿瘤尺寸并延长存活时间,为化疗药物开辟了新的给药途径 。
05CAR外泌体不引发细胞因子释放综合征
CAR - T疗法疗效显著,却伴有严重毒性,细胞因子释放综合征(CRS)是主要不良事件,由强烈免疫激活引发。细胞层面,激活的淋巴与髓系细胞释放大量炎性细胞因子导致CRS。临床表现为发热、缺氧、低血压,严重时需重症监护。受肿瘤类型、负荷及CAR - T细胞种类影响,CRS发生率差异大。大B细胞淋巴瘤患者接受CAR - T治疗,CRS发生率约28% - 35%,3 - 4级CRS占1% - 22%,因产品而异。相比之下,CAR外泌体优势明显,不会引发CRS。小鼠乳腺癌模型实验中,递增剂量的CAR - T细胞使小鼠行为异常、体重减轻,细胞因子升高;而CAR外泌体对小鼠行为、体重无影响,未检测到细胞因子升高。Yang等人用抗间皮素CAR外泌体治疗小鼠,即便最大剂量也无毒性,小鼠体重和重要组织均正常,凸显其安全性 。
06检查CAR外泌体与ICANS的关系
在CAR - T细胞输注后的三到十天内,患者常出现免疫效应细胞相关神经毒性综合征(ICANS)。虽然ICANS多伴随细胞因子释放综合征(CRS)发生,但部分患者也会单独出现ICANS 。已有初步数据表明CAR外泌体不会引发CRS,然而,目前尚无研究证实其对ICANS的影响。相反,近期研究显示CAR外泌体可能与ICANS的发生有关。Storci等人对复发或难治性B细胞淋巴瘤患者输注CD - 19靶向CAR - T细胞后,检测了CAR外泌体水平。结果发现,输注后一小时就能检测到外泌体,且后续发生ICANS的患者,其CAR外泌体中位水平高于未发生者。将CAR外泌体与人源祖神经元和成熟神经元共同培养,会促使神经元应激标志物Enolase - 2+纳米颗粒释放量增加。随后对比发现,发生ICANS的患者体内Enolase - 2+水平高于未发生者。总体而言,这些数据表明CAR外泌体水平或许可作为ICANS发生的早期预测指标,不过还需进一步研究来阐明CAR外泌体分泌在ICANS发病机制中的作用。Felice等人的类似研究也支持这一结论,他们检测接受CAR - T治疗的B细胞淋巴瘤患者的CAR外泌体水平,发现血清浓度大于187.5 CAR EV/μl时,预测ICANS发作的特异性为83%,敏感性为100% 。
07制备外泌体的困难
在临床应用中,外泌体需要可靠、快速且能大规模合成的制备方法。当前技术在大量分离和纯化外泌体上存在困难。现有方法各有利弊,免疫亲和捕获虽能产出高纯度产品,但成本高、产量低;尺寸排阻色谱可经济地按外泌体直径范围分离,却易受相似尺寸脂蛋白污染;超滤快速且经济,但难以产出纯品;超速离心能实现高纯度、低成本和高产量,却可能破坏外泌体结构。综合考量,组合方案是较好选择,如超速离心、尺寸排阻色谱和重复过滤离心相结合,可提高产量和纯度,但比单一方法更耗时、昂贵。外泌体虽可储存,但需关注其随时间的颗粒损失和纯度降低问题。
08肿瘤来源的外泌体
恶性细胞如同T细胞一样,也能分泌自身的外泌体,这些肿瘤来源的外泌体(TDEs)与肿瘤微环境的形成及免疫监视逃避相关。TDEs的分子特征模拟其母肿瘤细胞表面,借此可与非恶性细胞产生的外泌体区分。比如,肝癌细胞分泌含高浓度miR - 1247 - 3p的外泌体,能将正常成纤维细胞转化为癌相关成纤维细胞,进而分泌促炎细胞因子。基于TDEs与母肿瘤细胞的相似性,外泌体液体活检成为研究热点,因其可在血液中分离、测序,对难以组织活检的病例意义重大,像肝癌中TDEs携带的miRNA - 92b可用于疾病监测。在免疫监视方面,部分实体瘤细胞通过分泌细胞外腺苷抑制抗肿瘤免疫,此过程依赖TDEs表达CD39和CD73将5′AMP转化为对免疫细胞有毒的腺苷,其中CD73是限速步骤,针对它的治疗研究已展开。此外,恶性细胞还能通过分泌含PD - L1的TDEs逃避免疫监视,其表达水平与多种肿瘤进展相关,可诱导T细胞失能、耗竭及凋亡。不过,研究发现双特异性T细胞抗体可利用外泌体PD - L1引导CD8+细胞毒性T细胞浸润肿瘤。尽管TDEs在肿瘤微环境中的具体作用有待深入研究,但现有成果已显示其重要性。

09临床结论和未来挑战
在过去十年,外泌体在癌症治疗领域展现出新的应用前景,有望改变癌症治疗格局。外泌体因携带反映其来源母细胞的多种蛋白质和遗传物质而备受关注。鉴于CAR - T细胞疗法在肿瘤学中的显著成效,CAR外泌体是否能带来益处成为研究焦点。相关新兴研究表明,外泌体含有可在体内杀伤肿瘤细胞的细胞毒性颗粒,且不会引发细胞因子释放综合征,安全性更高。其较小的物理尺寸有助于穿透血脑屏障,更深入地浸润实体肿瘤的细胞外基质,还能作为细胞外载体负载化疗药物,开创靶向给药新方式。然而,基于外泌体的疗法在临床应用中仍面临诸多挑战。例如,纯化工艺的优化是商业化外泌体产品推出的限速步骤,免疫亲和捕获、尺寸排阻色谱、超滤和超速离心等方法各有优劣,组合使用虽能提高产量和纯度,但成本高昂且耗时。此外,外泌体生物学的某些特性也给临床转化带来困难,如CAR外泌体虽利于穿透中枢神经系统,却可能比CAR - T细胞引发更高的免疫效应细胞相关神经毒性综合征发生率。尽管放射性标记、PET和SPECT成像技术进步使追踪外泌体更便捷,但在广泛应用前,仍需全面明确其体内行为。肿瘤来源的外泌体在肿瘤微环境中助力肿瘤细胞逃避免疫监视,因其可进入体循环,有望用于液体活检以监测疾病。随着外泌体纯化工艺的商业规模改进,外泌体疗法的临床应用或许指日可待 。
参考文献:Wang JS, Schellenberg SJ, Demeros A, Lin AY. Exosomes in review: A new frontier in CAR-T cell therapies. Neoplasia. 2025 Apr;62:101147. doi: 10.1016/j.neo.2025.101147. Epub 2025 Mar 3. PMID: 40037165; PMCID: PMC11923832.
相关推荐
2025-12-05
2025-12-05
2025-12-05








